Предметные олимпиады. 8-11 классы. Химия. Программа для установки через Интернет
| Код | СИ-19и |
| Авторы-составители | Бойко Л. П., Иванова Е.А., Пильникова Н. Н. |
| Издательство | Учитель, 2025 |
| Серия | Задания для подготовки к олимпиадам |
| Электронная версия | скачать |
| УДК | 372.016:54*08/11 |
Инструкция по оплате и установке электронной продукции через Интернет: ознакомиться.
Покупка одного экземпляра программы дает право её использования на одном ПК.
Предназначено учителям химии, организаторам олимпиад.
Минимальные системные требования:
- операционная система - Windows XP/VISTA/7/8/8.1;
- процессор - Pentium-II;
- оперативная память - 256 МВ;
- разрешение экрана - 1024х768;
- свободное место на жестком диске - 400 МВ.
С этим товаром покупают
Примеры документов
Введение
Одним из основных в оценке деятельности образовательного учреждения является показатель динамики образовательных достижений. На основе выявления характера динамики образовательных достижений обучающихся можно оценивать эффективность учебного процесса, работы учителя или образовательного учреждения, системы образования в целом.
Одним из наиболее адекватных инструментов оценки динамики образовательных достижений служит портфель достижений ученика. Портфель достижений может быть отнесен к разряду аутентичных индивидуальных оценок, ориентированных на демонстрацию динамики образовательных достижений в широком образовательном контексте.
В портфель достижений ученика рекомендуется включать материалы, характеризующие достижения обучающихся в рамках внеучебной (школьной и внешкольной) и досуговой деятельности: результаты участия в олимпиадах, конкурсах, смотрах и др. Основное требование, предъявляемое к этим материалам, – отражение в них степени достижения планируемых результатов в рамках освоения предметного курса «Химия» на базе основного и среднего общего образования согласно ФГОС.
В пособии представлены олимпиадные задания с ответами по химии для учащихся 8–11 классов. Авторы дают несколько вариантов заданий. Творчески работающий учитель может варьировать содержательную часть, самостоятельно формируя, изменяя блоки заданий, ведя подготовку обучающихся поступательно, давая возможность всем желающим попробовать свои силы в выполнении олимпиадных заданий. Общий объем заданий олимпиады подобран таким образом, чтобы выявить детей с высоким интеллектуальным потенциалом, обладающих нестандартным мышлением и способных к выдвижению новых идей. Время на выполнение заданий не регламентируется, что позволяет быть успешными также детям, которые в силу своих индивидуальных особенностей работают в медленном темпе.
В ходе проверки выполненных заданий проводится статистический анализ, позволяющий определить их сложность. С одной стороны, это дает возможность объективизировать систему оценивания. С другой стороны, статистический анализ выполнения учащимися тех или иных заданий позволяет судить об эффективности школьного образования в формировании способности использовать предметные знания при решении учебно-познавательных и учебно-практических задач с привлечением средств, релевантных содержанию учебного предмета (использование знаково-символических средств; моделирование; сравнение, группировка и классификация объектов; действия анализа, синтеза, сравнения и обобщения; установление связей и аналогий; поиск, преобразование, представление и интерпретация информации, рассуждения)*.
Предназначено учителям химии для подготовки учащихся к олимпиадам, может быть использовано в качестве дополнительного материала в урочной и внеклассной работе; рекомендовано родителям для занятий с детьми по развитию интеллектуальных, творческих способностей, расширению кругозора.
III тур (отборочный, районный)
III тур (отборочный, районный)
Задание, оцениваемое в 4 балла.
1. Методом электронного баланса расставьте коэффициенты в уравнении окисления трехсернистого мышьяка азотной кислотой по схеме:
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO.
Задания, оцениваемые в 7 баллов.
1. К 20 г смеси карбоната кальция и гидрокарбоната калия прибавлен избыток соляной кислоты. Выделившийся при этом газ пропущен через избыток баритовой воды (Ba(OH)2). Вычислите массу образовавшегося при этом осадка.
2. При окислении неизвестного кислородсодержащего предельного органического соединения массой 1,8 г аммиачным раствором нитрата серебра получили серебро массой 5,4 г. Определите состав органического вещества, подвергнутого окислению.
Задания, оцениваемые в 10 баллов.
1. Еще в давние времена люди заметили, что в винных бочках при длительном хранении вина на стенках образуется налет, который они назвали «винным камнем». Лишь несколько веков спустя ученые выяснили, что это вещество – кислая соль винной (2,3-дигидроксибутандиовой) кислоты и металла Х (ω(С) = 25,53 %).
1) Определите металл Х, а также структурную формулу «винного» камня. Приведите необходимые расчеты. Как сейчас называется «винный камень»?
2) Какая соль металла Х использовалась в Средние века в производстве мыла? Как ее тогда называли?
3) Опишите физические свойства металла Х, напишите уравнение реакции его горения на воздухе, назовите продукт реакции. В какой цвет окрашивают пламя спиртовки соединения Х?
При нейтрализции «винного камня» едким натром (реакция 1) образуется сегнетова соль, имеющая в своем составе атомы пяти химических элементов. Смешением водного раствора медного купороса и щелочного раствора сегнетовой соли (реакция 2) можно получить темно-синюю фелингову жидкость, которая используется в качественном анализе для обнаружения углеводов.
Напишите уравнения реакций (1–3), если известно, что один из продуктов реакции 2 – комплексная соль меди, сходная по строению с продуктом реакции этиленгликоля и свежеприготовленного гидроксида меди (II) (реакция 3). Реакцию 2 запишите в сокращенной ионной форме. Как называются комплексы такого типа?
2. В молекулу пиридина помимо атомов углерода и водорода входит еще и атом азота. Известно, что массовая доля углерода в пиридине составляет 75,9 %, водорода – 6,3 %, остальное – азот.
1) Установите структурную формулу пиридина, если известно, что он является ароматическим соединением (согласно правилу Хюккеля ароматической является плоская моноциклическая сопряженная система, содержащая (4n + 2) π-электронов, где n = 0,1,2…).
2) Являются ли ароматическими следующие соединения?
Циклопентадиен 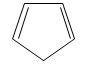
Циклооктатетраен 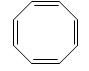
Тиофен 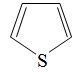
3. Современной промышленности часто требуются высокочистые металлы. Есть много способов их очистки, один из которых – метод электрохимического рафинирования. Так, для получения металла X высокой чистоты через водный раствор его сульфата пропускают электрический ток с электродами, сделанными из Х. При пропускании в течение двух часов через этот раствор тока силой 15 А на аноде выделилось 89,3 г металла Х.
1) Определите металл Х (известно, что он входит в число «семи металлов древности»). Ответ подтвердите расчетом.
2) Какие минералы, в состав которых входит металл Х, вы знаете? Приведите химические формулы двух из них, а также названия.
Если к Х прилить избыток концентрированной серной кислоты, то образуется раствор соли А (реакция 1), добавление к которому NaOH вызывает выпадение осадка Б сине-голубого цвета (реакция 2). Добавляя Б к раствору формальдегида при нагревании, можно получить соединение В (реакция 3), а также вещество Г желтого цвета. В ходе реакции наблюдается изменение окраски раствора с желтой до красной.
1) Определите вещества А–Г, напишите упомянутые уравнения реакций и назовите их продукты, если известно, что А, Б, Г содержат Х, а В – нет.
2) С помощью уравнения реакции объясните, почему раствор в реакции 3 краснеет не сразу.
4. Рассмотрите следующую схему превращений:
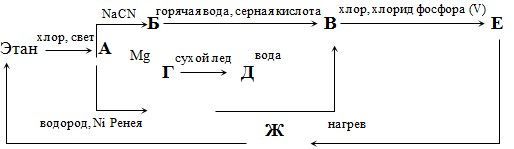
I тур (отборочный, в классе)
I тур (отборочный, в классе)
Вариант 1
Задания, оцениваемые в 5 баллов.
1. В записи 3SO3 коэффициент равен:
a) 3; в) 9;
б) 10; г) коэффициент отсутствует.
2. Относительная масса двух молекул оксида серы (IV) SO2 равна:
а) 32; б) 80; в) 64; г) 48.
3. Массовая доля бария в оксиде бария (ВаО) равна:
a) 50; б) 73,7; в) 10,5; г) 89,5.
4. Степень окисления железа в соединении Fe2О3 равна:
a) +2; б) +3; в) +4; г) +6.
5. Коэффициентами уравнения ...Fe + ...Сl2 = ...FeCl3 являются цифры:
а) 2, 3, 2; б) 4, 5, 2; в) 2, 5, 4; г) 2, 2, 6.
Вариант 2
Задания, оцениваемые в 5 баллов.
1. В записи 5Na2СО3 индексами являются:
а) 5, 2, 3; б) 10 и 15; в) 2 и 3; г) 10, 5, 15.
2. Относительная масса двух молекул сероводорода H2S равна:
а) 68; б) 18; в) 34; г) 48.
3. Массовая доля меди в оксиде меди (I) Cu2O равна:
а) 5; б) 25; в) 40; г) 88,9.
4. Степень окисления хрома в соединении Сr2О3 равна:
а) +2; б) +3; в) +4; г) +6.
5. Коэффициентами уравнения ...N2 + ...Н2 = ...NH3 являются цифры:
а) 2, 3, 1; б) 1, 2, 3; в) 1, 3, 2; г) 3, 4, 6.
Вариант 3*
Выберите правильный вариант ответа.
1. Наиболее распространенным элементом в межзвездном пространстве является:
а) кислород; в) кремний;
б) водород; г) гелий.
2. Наибольшую молярную массу имеет вещество с формулой:
а) H2S; в) H2Se;
б) H2Te; г) H2O.
3. В свободном состоянии встречается в природе:
а) азот; в) сера;
б) углерод; г) все перечисленные.
4. В ядре атомов отсутствуют частицы:
а) нейтроны; в) электроны;
б) протоны; г) все ответы верны.
5. В аммиаке и хлориде бария химическая связь соответственно:
а) ковалентная неполярная и металлическая;
б) ковалентная полярная и ионная;
в) ковалентная неполярная и ионная;
г) ионная и ковалентная полярная.
6. Закон сохранения массы веществ объясняется тем, что в ходе реакции не изменяется:
а) качественный и количественный состав вещества;
б) общее число молекул всех веществ;
в) общее число атомов всех элементов;
г) все перечисленное.
7. Воздушный шар взлетит, если его наполнить любым газом из набора (давление внутри шара считать нормальным, массой шара пренебречь):
а) гелий, аргон;
б) водород, углекислый газ;
в) аммиак, неон;
г) водород, кислород.
8. Наиболее распространенным элементом в земной коре является:
а) водород; в) кремний;
б) кислород; г) углерод.
9. Общее число атомных орбиталей на третьем энергетическом уровне равно:
а) 8; в) 6;
б) 9; г) 3.
10. В переводе с греческого atomos означает:
а) неделимый; в) простейший;
б) главный; г) мельчайший.
11. Кислород, занимающий при н. у. объем 4,48 л, имеет массу (г):
а) 6,8; в) 8,4;
б) 3,2; г) 6,4.
12. Восьмиэлектронную оболочку имеет ион:
III тур (отборочный, районный)
III тур (отборочный, районный)*
Задание, оцениваемое в 2 балла.
1. Как из смеси двух твердых солей – хлорида магния и хлорида аммония – выделить соль магния?
Задания, оцениваемые в 3 балла.
1. Допишите уравнения реакций. Для тех реакций, которые протекают практически до конца, запишите уравнения в молекулярном, полном ионном и сокращенном ионном виде:
а) Fe(NO3)2 + H2SO4 =…;
б) CuCl2 + KOH =…;
в) гидрокарбонат натрия + соляная кислота = …
2. Определите общее число протонов, электронов и нейтронов в молекуле серной кислоты, содержащей изотоп 34S.
Задания, оцениваемые в 4 балла.
1. Соединения бария ядовиты, однако сульфат бария принимают внутрь (до 200 г) при рентгенологическом исследовании желудка.
Почему использование сульфата бария в данном случае безопасно? Почему для этой цели нельзя использовать карбонат бария? Ответ подтвердите уравнением реакции.
2. Какую массу воды необходимо добавить, чтобы из 10 г 70%-ной уксусной эссенции получить 6%-ный раствор уксуса?
Задания, оцениваемые в 5 баллов.
1. Массовая доля химического элемента в его водородном соединении 17,65 %. Определите химический элемент и молекулярную формулу данного соединения.
2. Смесь, состоящую из хлора массой 0,75 г и водорода объемом 0,23 л, подвергли действию ультрафиолетового облучения. Считая, что реакция прошла полностью, определите число всех частиц в образовавшейся смеси.
3. Предложите не менее пяти способов получения хлорида натрия. Напишите уравнения реакций и условия их протекания, если таковые имеются.
4. Серебристо-белый, легкий, довольно твердый металл А при взаимодействии с простым газообразным веществом Б образует соединение В. Вещество В растворимо в воде с образованием щелочного раствора. При обработке вещества В серной кислотой образуется соль Г, кристаллогидрат которой Д применяется в медицине для наложения фиксирующих повязок при переломах. Соль Г при температуре около 1500 °С разлагается с образованием веществ Б, В, Е. Назовите вещества А, Б, В, Г, Д, Е и напишите уравнения описанных реакций.
5. Смесь медных и магниевых опилок массой 1,5 г обработали избытком соляной кислоты. В результате реакции выделился водород объемом 0,56 л (н. у.). Вычислите массовую долю меди в смеси.
Задание, оцениваемое в 6 баллов.
1. В трех сосудах без этикеток находятся растворы карбоната натрия, хлороводородной кислоты и гидроксида бария. Не прибегая к помощи других реактивов, определите, в каком из сосудов находится то или иное вещество. Ответ проиллюстрируйте уравнениями соответствующих реакций.
Задания, оцениваемые в 7 баллов.
1. Напишите уравнения реакций, соответствующие следующим превращениям (А, Б, В – соединения меди):
![]()
2. При частичном растворении 4 г смеси медных и магниевых опилок в избытке соляной кислоты выделилось 1,12 л водорода (н. у.). Установите состав исходной смеси в процентах по массе.
Задания, оцениваемые в 8 баллов.
1. В четырех пробирках находятся порошки оксида меди (II), оксида железа (III), серебра и железа. Используйте один из предложенных реактивов: NaOH, HCl (разб), H2O, Na2CO3, с помощью которого можно распознать каждое вещество.
2. Расставьте коэффициенты в схеме методом электронного баланса. Укажите процессы окисления и восстановления, назовите окислитель(и) и восстановитель(и). Запишите уравнение этого процесса в полной и сокращенной ионной формах.
FeS2 + HNO3 (конц) → Fe(NO3)3 + H2SO4 + NO + H2O.
Задания, оцениваемые в 10 баллов.
1. О золоте сложено немало пословиц и поговорок. О каких физических свойствах металлов рассказывают пословицы: «Золотые цветы не пахнут»; «Золотой иглой немного нашьешь»; «В бою железо дороже золота»; «В руках кузнеца железо струится, как вода»?
2. В Древнем Риме военачальник получил в награду 1,5 таланта, 16 мин и 125 сиклей серебра. Сколько молей серебра он получил, если 1 талант – это 30 кг, 1 мина – 0,5 кг, а 1 сикль – 8 г? Мог ли он унести свою награду в свинцовом эквиваленте, если обмен производился по курсу 1 моль к 180?
3.
III тур (отборочный, районный)
III тур (отборочный, районный)
Задания, оцениваемые в 5 баллов.
1. Составьте уравнения химических реакций, соответствующие следующей схеме превращений:
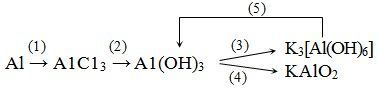
2. Имеются неподписанные пробирки, содержащие хлорид бария, конц. серную кислоту, нитрат серебра, конц. HI и конц. раствор едкого калия. Как без использования посторонних реактивов и приборов определить содержимое каждой пробирки?
3. Составьте уравнения реакций в соответствии со схемой:
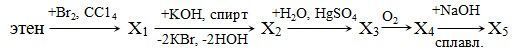
Расшифруйте неизвестные вещества: приведите их структурные формулы и названия.
4. Углеводород Х содержит 85,71 % (масс.) углерода. Он обесцвечивает бромную воду, а после его озонолиза был выделен единственный продукт: широко распространенная жидкость Y с характерным запахом, известная в быту как растворитель, с плотностью паров по воздуху 2,0, содержащая 62,07 % С и 10,34 % Н. Установите структуры X и Y.
5. Для полного сгорания 0,1 моль алкана потребовалось 14,56 л кислорода (н. у.). Установите формулу алкана. Существуют ли изомеры у этого вещества? Если да, напишите их структурные формулы и дайте названия по международной номенклатуре.
Задание, оцениваемое в 6 баллов.
1. На дне Черного моря образуется сероводород. Это результат жизнедеятельности сульфатвосстанавливающих бактерий. Происходящий процесс можно выразить схемой:
CH4 + CaSO4 = CaCO3 + H2S↑ + H2O.
Составьте для данного уравнения электронный баланс, укажите окислитель и восстановитель. Рассчитайте, какой объем сероводорода, измеренный при н. у., образуется в 1 м3 морской воды, если содержание сульфата кальция в ней равно 27,2 мг/л.
Задание, оцениваемое в 7 баллов.
1. Состав каменного угля одного из месторождений (в массовых долях): C – 82,2 %; H – 4,6 %; S – 1 %; N – 1,2 %; H2O – 1 %; зола 10 %. Определите объем воздуха (н. у.), который потребуется для полного сгорания 1 кг такого угля.
Задание, оцениваемое в 8 баллов.
1. При сгорании 28 г смеси метана и этана получили 41,44 л углекислого газа (н. у.). Определите состав смеси углеводородов в массовых долях.
2. Соединение X, широко применяемое в быту в виде 3%-ного или 70–80%-ного водных растворов, является слабой кислотой. При взаимодействии 204 г 5%-ного водного раствора X с избытком NaOH и дальнейшем выпаривании смеси образуется 13,94 г белого порошка вещества А, которое используется в химических грелках, а также как консервант. При сплавлении А и сухого NaOH выделяется газ Б, являющийся важным химическим сырьем и незаменимым топливом. Смесь газа Б и хлора, взятая в объемном соотношении 1 : 1, реагирует на свету с образованием смеси веществ, основным компонентом которой является вещество В. В реакции В с бензолом в присутствии хлорида алюминия (III) образуется вещество Г, содержащее 91,3 % углерода по массе. При взаимодействии Г со смесью азотной и серной кислот образуется опасное взрывчатое вещество Д (считать, что реакция идет до конца).
1) Определите вещества А–Д, X и приведите их названия, где возможно – тривиальные.
2) Напишите уравнения всех упомянутых реакций, ответ подтвердите расчетом.
3) Есть ли среди описанных реакций именные? Назовите.
4) Каким свойством вещества А обусловлено его применение в химических грелках?
5) Какие еще способы получения вещества Б вы знаете? Приведите не менее двух способов.
3. Раствор гидроксида натрия массой 130 г полностью нейтрализовали, постепенно приливая 100 г раствора серной кислоты. После охлаждения ниже 32 °С весь раствор закристаллизовался. При прокаливании 1,61 г кристаллического вещества получилось 0,71 г твердого остатка.
1) Определите формулу вещества, выделившегося в результате кристаллизации.
2) Рассчитайте массовые доли кислоты и щелочи в исходных растворах.
Задание, оцениваемое в 9 баллов.
1. При сжигании 26,7 г аминокислоты СхНуОzNk
Товар размещен в разделах
QR-код страницы
Для партнеров
с учмагом













